കഴിഞ്ഞ പോസ്റ്റിന്റെ കമന്റില് സുനില്ചേട്ടന് പറഞ്ഞു:
സുനില് said...
ഷിജൂ, താങ്കള് ചെയ്യുന്നതിനെ അഭിനന്ദിയ്ക്കാതെ വയ്യ. എന്നാലും “കുറച്ചു സങ്കീര്ണ്ണമായ പ്രക്രിയയിലൂടെ അണുവിന്റേയും, ഇലക്ട്രോണുകളുടേയും മറ്റ് അണുകണികകളുടേയും ന്യൂക്ലിയര് കണികകളുടേയും മറ്റും ചലനത്തിന്റെ പ്രതിഫലനമായാണ് വിദ്യുത്കാന്തിക “ ഇതൊക്കെ വായിക്കുമ്പോള് സങ്കീര്ണ്ണമായ ഈ പ്രക്രിയ എന്താണ്? ഈ പ്രക്രിയയ്കുള്ള ഊര്ജ്ജം എവിടുന്ന് കിട്ടി എന്നൊക്കെ ചോദിക്കാന് തോന്നുന്നു. ബ്ലോഗിന്റെ ഉദ്ദേശം തെറ്റിക്കാതെ മറുപടിയെഴുതിയാല് ഉപകാരം. -സു-
അദ്ദേഹം ചോദിച്ച ഈ സംശയം ആണ് ഈ പോസ്റ്റ് എഴുതുന്നതിനു എന്നെ പ്രേരിപ്പിച്ചത്. ഈ പോസ്റ്റില് ജ്യോതിശാസ്ത്രത്തേക്കാള് ശുദ്ധ ഭൌതീകശാസ്ത്രം ആണ് കൈകാര്യം ചെയ്യുന്നത്. ഇതില് ചിലതൊക്കെ നമ്മള് സ്കൂള്, കോളേജ് തലത്തില് പഠിച്ചതാണ്. പക്ഷെ അതൊക്കെ ഒരു പ്രത്യേക രീതിയില് ജ്യോതിശാസ്ത്രത്തോട് ചേര്ന്നുനില്ക്കും വിധം കൈകാര്യം ചെയ്യാനാണ് ഈ പോസ്റ്റില് ശ്രമിച്ചിട്ടുള്ളത്.
എങ്ങനെയാണ് വിദ്യുത്കാന്തിക തരംഗങ്ങള് ഉണ്ടാവുന്നത്? രണ്ട് വിധത്തിലാണ് ഒരു വസ്തുവില് നിന്ന് വിദ്യുത്കാന്തികതരംഗങ്ങള് വികിരണം ചെയ്യുന്നത്.
- Thermal emission
- Non-thermal emission
ഈ പോസ്റ്റില് രണ്ടെണ്ണത്തെകുറിച്ചും വിശദീകരിച്ച് സംഗതി സങ്കീര്ണ്ണമാക്കാന് ഉദ്ദേശിക്കുന്നില്ല. പക്ഷെ രണ്ട് തരം emissionനിലും ഏറ്റവും പ്രധാനപ്പെട്ട ചിലത് പരിചയപ്പെടുത്തുക മാത്രമേ ഇവിടെ ഉദ്ദേശിക്കുന്നുള്ളൂ. ഈ ഒരു പോസ്റ്റില് (10 പോസ്റ്റില് പോലും) ഒതുങ്ങുന്നതല്ല ഈ
വിഷയം. ഇവിടെ ഉദ്ദേശിക്കുന്നത് ജ്യോതിശാസ്ത്രവുമായി ഏറ്റവും കൂടുതല് പ്രാധാന്യമുള്ള കുറച്ച് കാര്യങ്ങള് പരിചയപ്പെടുത്തുക എന്നത് മാത്രമാണ്. ഇതു കൊണ്ട് ഇപ്രകാരം മാത്രമേ വിദ്യുത്കാന്തിക തരംഗങ്ങള് നിര്മ്മിക്കപ്പെടൂ എന്ന് അര്ത്ഥമില്ല. ഇതു വരെ ഉള്ള പോസ്റ്റുകളില് നിന്ന് ആര്ജ്ജിച്ച അറിവ് വച്ച് പരിചയപ്പെടുത്താന് പറ്റുന്നത് മാത്രമേ ഈ പോസ്റ്റില് ഈ കൈകാര്യം ചെയ്യുന്നുള്ളൂ. ശുദ്ധ ഭൌതീക ശാസ്ത്രമാണെകിലും ഇനി പറയാന് പോകുന്നതൊക്കെ ജ്യോതിശാസ്ത്രത്തിലെ പഠനത്തിനു ഉപയോഗിക്കുന്നതാണ്. സത്യത്തില് ജ്യോതിശാസ്ത്രം അതിന്റെ പഠനത്തിനു സഹായി ആയി ഉപയോഗിക്കാത്ത ശാസ്ത്രശാഖകള് ഇല്ല എന്നു തന്നെ പറയാം.
കഴിഞ്ഞ പോസ്റ്റില് നമ്മള് പരിചയപ്പെട്ട Wein's law ഒക്കെ പറയുന്ന വിധത്തില് ഉണ്ടാകുന്ന വിദ്യുത്കാന്തികതരംഗങ്ങള് ആണ് Thermal emission വഴി ഉണ്ടാകുന്നത്. അതായത് ഒരു വസ്തുവിന്റെ താപം മൂലം (black body radiation) അത് പുറപ്പെടുവിക്കുന്ന വിദ്യുത്കാന്തികതരംഗങ്ങള്. Black body radiation കൂടാതെ രണ്ട് പ്രധാന തരത്തില് കൂടെ Thermal emission മൂലം വിദ്യുത്കാന്തികതരംഗങ്ങള് ഉണ്ടാകുന്നുണ്ട്. അയണീകൃത വാതകങ്ങളില് സംഭവിക്കുന്ന free-free emissionഉം മറ്റൊന്ന് spectral line emissionഉം. താപം മൂലമല്ലാതെ മറ്റു വിധത്തില് നിര്മ്മിക്കപ്പെടുന്ന വിദ്യുത്കാന്തികതരംഗങ്ങളാണ് Non-thermal emission വഴി വികിരണം ചെയ്യുന്നത്.
Blackbody Radiation
ഇതിനെ കുറിച്ച് നമ്മള് പോസ്റ്റില് മനസ്സിലാക്കി എങ്കിലും കുറച്ചു കാര്യങ്ങള് കൂടി. 0 K നു മുകളില് താപനില ഉള്ള ഏത് വസ്തുവും താപ വികിരണം പുറത്തുവിടും എന്ന് കഴിഞ്ഞ പോസ്റ്റില് പറഞ്ഞുവല്ലോ. ഒരു വസ്തുവിനേയും 0 K എന്ന മാന്ത്രിക താപനിലയിലേക്ക് തണുപ്പിക്കാന് പറ്റില്ല. അതിനര്ത്ഥം ഈ പ്രപഞ്ചത്തിലുള്ള എല്ലാ വസ്തുക്കളും താപ വികിരണം (thermal radiation) പുറത്തു വിടുന്നു എന്നാണ്.
ഒരു വസ്തുവിന്റെ താപനില മൂലം അതിലുള്ള അണുക്കളും തന്മാത്രകളും നിരന്തരചലനത്തിലാണ്. ഇങ്ങനെ ഉള്ള ചലനം മൂലം ഈ അണുക്കള് കൂട്ടിമുട്ടുന്നു. അങ്ങനെ കൂട്ടിമുട്ടുമ്പോള് അവയുടെ ദിശ മാറുന്നു. ദിശ മാറുന്നു എന്നു പറഞ്ഞാല് ത്വരണം ഉണ്ടാകുന്നു എന്നാണ് അര്ത്ഥം. ഇലക്ട്രിക് ചാര്ജ്ജ് ഉള്ള ഒരു കണത്തിനു ത്വരണം ഉണ്ടായാല് അത് വിദ്യുത്കാന്തിക തരംഗം പുറപ്പെടുവിക്കും എന്നു നമ്മള് സ്കൂള് കോളേജ് തലത്തിലെ ഫിസിക്സില് പഠിച്ചിട്ടുണ്ടല്ലോ. അതു കൊണ്ട് ഒരോ പ്രാവശ്യവും അണുക്കള് ദിശ മാറുമ്പോള് അത് വിദ്യുത്കാന്തിക തരംഗം പുറപ്പെടുവിക്കും. ഇങ്ങനെയാണ് ഈവിധത്തില് വിദ്യുത് കാന്തിക തരംഗങ്ങള് നിര്മ്മിക്കപ്പെടുന്നത്.
(ഇതില് കൂടുതല് ഇത് വിശദീകരിക്കുന്നില്ല. ഇതിനെ കുറിച്ച് കൂടുതല് അറിയുവാന് താല്പര്യം ഉള്ളവര് പ്ലസ് 2 ലെവലിലോ ഡിഗ്രി തലത്തിലോ ഉള്ള ഫിസിക്സ് പുസ്തകം വായിച്ചു നോക്കൂ)
പക്ഷെ ഇങ്ങനെ പുറപ്പെടുവിക്കുന്ന വിദ്യുത്കാന്തിക തരംഗത്തിന്റെ തരംഗ ദൈര്ഘ്യം അതിന്റെ താപനിലയ്ക്ക് അനുപാതമായിരിക്കും. ഇതാണ് Wein's law യില് കൂടെ നമ്മള് കഴിഞ്ഞ പോസ്റ്റില് മനസ്സിലാക്കിയത്. കഴിഞ്ഞ പോസ്റ്റില് ഒരു വെല്ഡര് ഇരുമ്പ് ചൂടാക്കുന്നതിനെ കുറിച്ചുള്ള കാര്യം ചിത്ര സഹിതം വിശദകരിച്ചിരുന്നുവല്ലോ. അത് ഇനി ഒന്നു കൂടി വായിച്ചു നോക്കൂ.
അപ്പോള് ചുരുക്കി പറഞ്ഞാല് ചാര്ജുള്ള കണങ്ങളും തന്മാത്രകളും മറ്റും അതിന്റെ വേഗതയോ സഞ്ചാരത്തിന്റെ ദിശയോ മാറ്റുമ്പോമ്പോഴാണ് വിദ്യുത്കാന്തിക തരംഗം പുറപ്പെടുവിക്കുന്നത്. ഇതിനെയാണ് ശാസ്ത്രജ്ഞന്മാര് Blackbody Radiation എന്നു വിളിക്കുന്നത്.
Free-Free Emission
ഇനി മറ്റൊരു തരത്തിലുള്ള താപ വികിരണം (thermal emission) വരുന്നത് അയണീകൃതമായ വാതകങ്ങളില് നിന്നാണ്. അണുക്കള് അയണീകൃതമാകുന്നത് അതിന്റെ ഇലക്ട്രോണ് നഷ്ടപ്പെടുമ്പോഴാണ്. ഇങ്ങനെ സ്വതന്ത്രമാക്കപ്പെട്ട ഇലക്ട്രോണും അയണീകൃതമായ കണങ്ങളും ഉള്പ്പെട്ട പദാര്ത്ഥത്തിന്റെ നാലാമത്തെ അവസ്ഥയായ പ്ലാസ്മയിലേക്ക് മാറ്റപ്പെടുന്നു. ഇങ്ങനെ ഉള്ള പദാര്ത്ഥത്തില് ഇലക്ട്രോണുകള്ക്ക് കണങ്ങളുടെ ആകര്ഷണം മൂലം തുടര്ച്ചയായ ത്വരണം സംഭവിച്ചു കൊണ്ടിരിക്കും. അപ്പോള് അത് വിദ്യുത് കാന്തിക തരംഗങ്ങള് പുറപ്പെടുവിക്കും. ഇത്തരം വികിരണത്തെ Free-Free Emission അല്ലെങ്കില് bremsstrahlung എന്നു വിളിക്കുന്നു. ഇതു മൂലം ഉണ്ടാകുന്ന വിദ്യുത് കാന്തിക തരംഗങ്ങള് കൂടുതലും എക്സ് കിരണങ്ങള് അല്ലെങ്കില് ഗാമാകിരങ്ങള് ആയിരിക്കും.
ഈ വികിരണത്തിന്റെ ഒരു അനിമേഷന് കാണണമെങ്കില് ഈ ലിങ്കില് ഞെക്കിയാല് തുറന്നു വരുന്ന വെബ്ബ് പേജില് Free-Free Emission നു നേരെയുള്ള ചിത്രത്തില് ഒന്ന് ഞെക്കി നോക്കൂ. ഈ തുറന്നു വരുന്ന പേജില് Free-Free Emissionനു പുറമേ താഴെ പരിചയപ്പെടുത്തുന്ന മിക്കതിന്റേയും/ അതോടൊപ്പം പരിചയപ്പെടുത്താതെ വിടുന്നതിന്റേയും (ഉദാ: Synchrotron Emission)അനിമേഷനുകള് കാണാം. എല്ലാം ഒന്ന് പ്ലേ ചെയ്ത് നോക്കി അതിന്റെ പ്രവര്ത്തനം മനസ്സിലാക്കൂ. മാത്രമല്ല കൂടുതല് അറിയണമെന്ന് താല്പര്യം ഉള്ളവര്ക്ക് അതില് കൊടുത്തിരിക്കുന്ന ലിങ്കുകള് പിന്തുടരാം.പക്ഷെ ആദ്യം ഈ ലേഖനം വായിക്കൂ.
Spectral Line Emission
അടുത്തത് സ്പെക്ട്രല് ലൈന് വികിരണം ആണ്. ഇത് ജ്യോതിശാസ്ത്രത്തില് വളരെ പ്രാധാന്യമുള്ള ഒന്നാണ്. നക്ഷത്രത്തിന്റെ ഒക്കെ Spectral Line Emission നോക്കിയിട്ടാണ് അതില് ഏതൊക്കെ മൂലകങ്ങള് ഉണ്ടെന്ന് ജ്യോതിശാസ്ത്രജ്ഞന്മാര് മനസ്സിലാക്കുന്നത്. Spectroscopy എന്ന ശാസ്ത്രശാഖ ഇതിനെ കുറിച്ചുള്ള പഠനമാണ്. നമുക്ക് ഇതിന്റെ കുറച്ച് അടിസ്ഥാനപരമായ കാര്യങ്ങള് മനസ്സിലാക്കാം.
ഒരു അണുവിലെ ഇലക്ട്രോണ് അതിന്റെ ഉയര്ന്ന പഥത്തില് നിന്ന് താഴ്ന്ന പഥത്തിലേക്ക് ചാടുമ്പോള് (അല്ലെങ്കില് തിരിച്ച്) ആ പഥങ്ങളുടെ ഊര്ജ്ജനിലകള് തമ്മിലുള്ള വ്യത്യാസത്തിനു തുല്യമായ ഊര്ജ്ജം (അതായത് വിദ്യുത്കാന്തിക തരംഗം) പുറത്തുവിടുന്നു (അല്ലെങ്കില് ആഗിരണം ചെയ്യുന്നു). ഇങ്ങനെ ഒരു പ്രത്യേക തരംഗദൈര്ഘ്യത്തില് പുറത്തുവരുന്ന (അല്ലെങ്കില് ആഗിരണം ചെയ്യപ്പെടുന്ന) വിദ്യുത്കാന്തികതരംഗം വിദ്യുത്കാന്തികവര്ണ്ണരാജിയില് ഒരു വര ആയി കാണപ്പെടും. ഇതാണ് Spectral Line Emission/absorption എന്നത് കൊണ്ട് ഉദ്ദേശിക്കുന്നത്. മനസ്സിലായില്ല അല്ലേ. താഴേക്ക് വായിക്കൂ. ഈ പോസ്റ്റിന്റെ സിംഹഭാഗവും ഇത് വിശദീകരിക്കാണ് പോകുന്നത്. കാരണം ജ്യോതിശാസ്ത്രത്തില് ഇതിന്റെ പ്രാധാന്യം അത്രയ്ക്ക് വലുതാണ്.
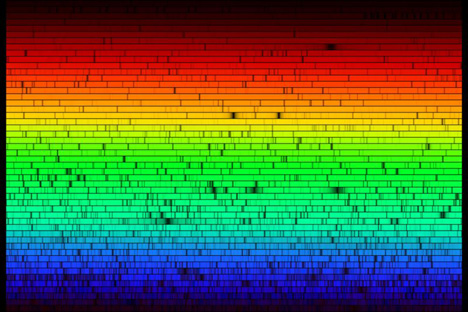
ന്യൂട്ടന് പ്രിസം ഉപയോഗിച്ച് സൂര്യപ്രകാശത്തില് നിന്നു വര്ണ്ണരാജി ഉണ്ടാക്കിയ കാര്യം നമുക്കെല്ലാം അറിവുള്ളതാണല്ലോ. 1814-ല് ജര്മ്മന് കാരനായ Fraunhofer ഈ പരീക്ഷണം ഒന്ന് കൂടി ആവര്ത്തിച്ചു. പക്ഷെ ഇത്തവണ Fraunhofer പ്രിസത്തില് നിന്നു വരുന്ന വര്ണ്ണ രാജിയെ പര്വ്വതീകരിച്ച് (magnify) വീക്ഷിച്ചു. അദ്ദേഹത്തെ അത്ഭുതപ്പെടുത്തികൊണ്ട് ആ വര്ണ്ണ രാജിയില് ഏണ്ണകണക്കിനു കറുത്ത വരകള് ഉള്ളതായി കണ്ടു. ഇന്ന് നമ്മള് ഇതിനെ spectral lines എന്നാണ് വിളിക്കുന്നത്. പക്ഷെ ഒരു Blackbodyയില് നിന്നു വരുന്ന വികിരണം ഇങ്ങനെ വരകള് ഒന്നും ഇല്ലാതെ തുടച്ചയായതും സുഗമമായതും ആയിരിക്കും എന്ന് നമ്മള് കഴിഞ്ഞ പോസ്റ്റില് നിന്നു മനസ്സിലാക്കിയിരുന്നല്ലോ. പക്ഷെ ഈ വരകള് എങ്ങനെയാണ് ഉണ്ടാകുന്നത് എന്ന് വിശദീകരിക്കാന് അന്നത്തെ ശാസ്ത്രത്തിനായില്ല.
Fraunhofer സൌരവര്ണ്ണരാജിയില് ഏതാണ്ട് 600 dark spectral lines എണ്ണി. ഇന്ന് നമ്മള്ക്ക് ഏതാണ്ട് 30,000 ത്തിലധികം dark spectral lines-നെ അറിയാം. ഇതോടൊപ്പം കൊടുത്തിരിക്കുന്ന സൌരവര്ണ്ണരാജിയില് ആയിരക്കണക്കിനു dark spectral lines-നെ നിങ്ങള്ക്ക് കാണാവുന്നതാണ്.
സൌര വര്ണ്ണ രാജി
Image credit. The National Radio Astronomy Observatory (NRAO)
അരനൂറ്റാണ്ടിനു ശേഷം സൂര്യനില് മാത്രമല്ല ഭൂമിയിലെ പരീക്ഷണ ശാലകളില് തന്നെ വിവിധ മൂലകങ്ങളില് നിന്നു വരുന്ന സ്പെക്ട്രല് വികിരണങ്ങള് തങ്ങള്ക്ക് വേര്തിരിക്കാനാവും എന്നു രസതന്ത്രജ്ഞര് തെളിയിച്ചു. മാത്രമല്ല സ്പെക്ട്രല് വരകള് നോക്കി ഒരു വസ്തു എന്ത് മൂലകങ്ങള് കൊണ്ടാണ് നിര്മ്മിച്ചിരിക്കുന്നത് എന്ന് കണ്ടെത്താനാവുമെന്നും അവര് തെളിയിച്ചു. ജര്മ്മന് ഭൌതീകശാസ്ത്രജ്ഞനായ Kirchoff-ഉം രസതന്ത്രജ്ഞനായ Bunsenഉം ഒരോ മൂലകവും സമാനകളില്ലാത്ത spectral lines വികിരണം ചെയ്യും എന്ന് മനസ്സിലാക്കി. അങ്ങനെ 1859-ല് spectral analysis എന്ന ശാസ്ത്ര സമ്പ്രദായത്തിനു തുടക്കമായി.
Kirchoff ഉം Bunsenഉം കൂടിച്ചേര്ന്ന് അന്ന് അവര്ക്ക് അറിവുണ്ടായിരുന്ന എല്ലാ മൂലകങ്ങളുടേയും spectral lines പരീക്ഷണശാലയില് നിര്മ്മിച്ചു സൂക്ഷിച്ചു. അതിനുശേഷം അവര് ചില രാസ രാസംയുക്തങ്ങളുടെ spectral lines ഉണ്ടാക്കിനോക്കിയപ്പോള് അവര്ക്ക് അത് അന്ന് പരിചയം ഉണ്ടായിരുന്ന മൂലകങ്ങളുടെ ഒന്നും അല്ല എന്ന് കണ്ടെത്തി. ഉദാഹരണത്തിന് 1860-ല് ധാതുജലത്തിന്റെ വര്ണ്ണരാജി ഉണ്ടാക്കി നോക്കിയപ്പോള് നീലവര്ണ്ണത്തിന്റെ ഭാഗത്ത് ഒരു പുതിയ വര കണ്ടെത്തി. ഈ വര അവര്ക്ക് അന്ന് അറിയുമായിരുന്ന ഒരു മൂലകത്തിന്റെ വര്ണ്ണരാജിയിലും ഉണ്ടായിരുന്നില്ല. അതിനാല് ഇത് ഒരു പുതിയ മൂലകത്തില് നിന്നാവാം എന്ന് അവര് ഊഹിച്ചു. അവര് ആ spectral line ഉണ്ടാക്കുന്ന മൂലകത്തെ ലാറ്റിനില് gray-blue എന്ന് അര്ത്ഥം വരുന്ന Caesium എന്ന് വിളിച്ചു. അടുത്ത വര്ഷം അവര് ഇതേ പോലെ വേറൊരു ധാതുവില് പരീക്ഷണം നടത്തുമ്പോള് ചുവപ്പിന്റെ ഭാഗത്ത് ഒരു പുതിയ വര കണ്ടെത്തി. ഈ വര ഉണ്ടാക്കുന്ന മൂലകത്തെ ലാറ്റിനില് red എന്നര്ത്ഥം വരുന്ന Rubidium എന്ന് അവര് വിളിച്ചു.
ഇങ്ങനെ spectral analysis മൂലം പല പുതിയ മൂലകങ്ങളേയും കണ്ടെത്താന് ശാസ്ത്രജ്ഞന്മര്ക്ക് സാധിച്ചു. ഭൂമിക്ക് പുറത്തും പുതിയ മൂലകങ്ങളെ കണ്ടെത്താന് അവര്ക്ക് കഴിഞ്ഞു. 1868-ലെ സൂര്യഗ്രഹണ സമയത്ത് സൂര്യന്റെ upper surface-ല് നിന്ന് വരുന്ന വികിരണത്തിന്റെ വര്ണ്ണരാജിയില് പുതിയ ഒരു വര അവര് കണ്ടു. ഈ വര ഉണ്ടാക്കുന്ന മൂലകത്തെ ഗ്രീക്കില് സൂര്യന് എന്നര്ത്ഥം വരുന്ന helios എന്ന വാക്കില് നിന്ന് ഉണ്ടാക്കിയ helium എന്നു വിളിച്ചു. ഈ മൂലകത്തെ 1895 വരെ ഭൂമിയില് കണ്ടെത്തിയിരുന്നില്ല.
Kirchoff laws
Kirchoff വര്ഷങ്ങളായുള്ള തന്റെ ഗവേഷണപരീക്ഷണങ്ങളുടെ നിഗമനങ്ങള് മൂന്നു നിയമങ്ങളില് ക്രോഡീകരിച്ചു. ഇത് ഇന്ന് Kirchoff laws എന്നാണ് അറിയപ്പെടുന്നത്. അത് എന്തൊക്കെയാണെന്ന് താഴെ പരിചയപ്പെടുത്തുന്നു.
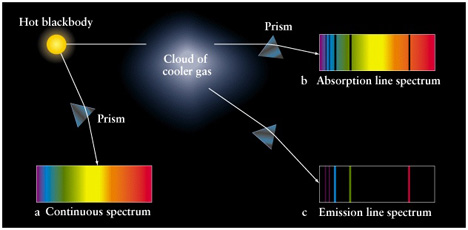
നിയമം 1. ചൂടുള്ള അതാര്യമായ (Opaque) വസ്തു അല്ലെങ്കില് സാന്ദ്രത കൂടിയ ചൂടുള്ള വാതകം spectral lines ഒന്നുമില്ലാത്ത Continuous Spectrum വികിരണം ചെയ്യുന്നു.
നിയമം 2. ചൂടുള്ള സുതാര്യമായ (transparent) വാതകം emission line spectrum വികിരണം ചെയ്യുന്നു. കറുത്ത പശ്ചാത്തലത്തിലുള്ള ഒരു സീരീസ് bright spectral lines ആയിട്ടാണ് emission spectrum കാണുക.
നിയമം 3. Continuous spectrum വികിരണം ചെയ്യുന്ന ഒരു വസ്തുവിന്റെ മുന്പിലുള്ള തണുത്ത സുതാര്യമായ (transparent) വാതകം absorption line spectrum വികിരണം ചെയ്യുന്നു. Continuous spectrum-ത്തില് അടക്കം ചെയ്ത ഒരു സീരീസ് dark spectral lines ആയിട്ടാണ് absorption spectrum കാണുക.
ഇതോടൊപ്പം ഒരു വാതകത്തിന്റെ absorption spectrumത്തില് dark spectral lines ഉള്ള അതേ സ്ഥാനത്തുതന്നെയായിരിക്കും അതേവാതകത്തിന്റെ emission line spectrum-ത്തിലെ bright spectral lines-ഉം ഉണ്ടാവുക. ഇതോടൊപ്പമുള്ള ചിത്രം കാണുക
മൂന്നു തരത്തിലുള്ള വികിരണങ്ങള്
Image credit. The National Radio Astronomy Observatory (NRAO)
ഒരു വാതക പടലത്തില് നിന്നു emission spectrum ആണോ absorption spectrum വരിക എന്നതു തീരുമാനിക്കുന്നത് ആ വാതകപടലത്തിന്റേയും അതിന്റെ പശ്ചാത്തലത്തിന്റേയും ആപേക്ഷിക താപനില ആണ്. പശ്ചാത്തലം വാതകത്തേക്കാള് ചൂടുള്ളതാണെങ്കില് absorption spectrum ഉം തണുത്തതാണെങ്കില് emission spectrumഉം വികിരണം ചെയ്യും.
Kirchoff ന്റെ നിയമങ്ങള് ക്രോഡീകരിച്ച് ഒരു ഉദാഹരണത്തിലൂടെ വ്യക്തമാക്കാം. ഒരു സ്രോതസ്സില് നിന്നുള്ള ധവള പ്രകാശ രശ്മി ഒരു വാതകത്തിലൂടെ കടന്നു പോകുന്നു എന്നും ഈ വാതകത്തിലെ അണുക്കള് ചില പ്രത്യേക തരംഗദൈര്ഘ്യത്തിലുള്ള വര്ണ്ണങ്ങള് ഈ രശ്മിയില് നിന്നു ആഗിരണം ചെയ്യുന്നു എന്നും കരുതുക. ഇനി വാതകത്തിലൂടെ കടന്നു വരുന്ന രശ്മിയെ നേരെ നോക്കുന്ന ഒരാള്ക്ക് (spectroscope എന്ന ഉപകരണം ഉപയോഗിച്ച്) ധവളപ്രകാശത്തില് അടക്കം ചെയ്ത dark absorption spectral lines ആണ് കാണാന് കഴിയുക.മാത്രമല്ല അതിനുശേഷം വാതകം, അത് ആഗിരണം ചെയ്ത തരംഗദൈര്ഘ്യങ്ങളെ എല്ലാ ദിശകളിലേക്കും വികിരണം ചെയ്യും. വാതകത്തെ നേരെയല്ലാതെ ചെരിഞ്ഞ ഒരു കോണില് നിന്നു spectroscope ഉപയോഗിച്ച് നോക്കിയാല് വാതകം വികിരണം ചെയ്യുന്ന bright emission spectral linesഉം കാണാം. ഇനി ഇതോടൊപ്പമുള്ള ചിത്രത്തില് ഈ മുകളില് പറഞ്ഞത് ഒരു Blackbodyയെ ആധാരമാക്കി വിവരിക്കുന്ന ഒരു ചിത്രം നോക്കൂ.
വിവിധ തരത്തിലുള്ള സ്പെക്ട്രം ഉണ്ടാകുന്നതെങ്ങനെ
Image credit. Universe, Kaufmann and Freedman, W H Freeman and Company, New York
Blackbodyയെ നേരിട്ട് (വാതകപടലത്തിലൂടെ അല്ലാതെ) spectroscope-ലൂടെ വീക്ഷിക്കുന്ന ഒരാള്ക്ക് Continuous spectrumഉം, Blackbodyയെ നേരെ വാതകപടലത്തിലൂടെ വീക്ഷിക്കുന്ന ആള്ക്ക് absorption spectrumഉം, വാതക പടലത്തെ ഒരു കോണിലൂടെ വീക്ഷിക്കുന്ന ആള്ക്ക് emission spectrumഉം ആണ് കാണാനാവുക. സ്വാഭാവികമായും വാതകത്തിലുള്ള മൂലകങ്ങള് ആണ് spectral lines വിദ്യുത്കാന്തിക വര്ണ്ണ രാജിയുടെ ഏത് ഭാഗത്ത് വരും എന്ന് തീരുമാനിക്കുക.
Spectroscopy എന്ന ശാസ്ത്രശാഖ പല തരം Spectra-കളുടേയും spectral linesന്റേയും ഒക്കെ ചിട്ടയായ പഠനമാണ്. അതിന്റെ പിറവിക്ക് വഴിതെളിച്ച ചില പ്രധാനസംഭവവികാസങ്ങളാണ് മുകളില് പരിചയപ്പെടുത്തിയത്. spectral lines ജ്യോതിശാസ്ത്രത്തിലെ പഠനത്തിന് വളരെ അത്യാവശ്യമാണ്. നക്ഷത്രങ്ങളില് നിന്നും മറ്റ് ഖഗോളവസ്തുക്കളില് നിന്നും ഒക്കെ വരുന്ന പ്രകാശത്തിന്റെ spectral lines പഠിക്കുന്നതിലൂടെയാണ് ജ്യോതിശാസ്ത്രജ്ഞന്മാര്ക്ക് ആ വസ്തുക്കളുടെ രാസസംയുക്തം മനസ്സിലാക്കാന് പറ്റുന്നത്.
ഇനി Kirchhoffന്റെ നിയമങ്ങള് ശരിക്ക് മനസ്സിലാകണം എങ്കില് അത് എങ്ങനെയാണ് പ്രവര്ത്തിക്കുന്നത് എന്ന് മനസ്സിലാക്കണം. എന്ത് കൊണ്ടാണ് ഒരു മൂലകം ചില പ്രത്യേക തരംഗദൈര്ഘ്യത്തിലുള്ള പ്രകാശം മാത്രം ആഗിരണം ചെയ്യുന്നത്. അതേ പോലെ ഈ മൂലകങ്ങള് എന്ത് കൊണ്ടാണ് ഇതേ തരംഗദൈര്ഘ്യത്തിലുള്ള പ്രകാശം മാത്രം വികിരണം ചെയ്യുന്നത്. ഇനി നമ്മള് അതിനുള്ള ഉത്തരം ആണ് തേടുന്നത്. ഇത് എന്താണെന്ന് മനസ്സിലാക്കണം എങ്കില് ആദ്യം അണുവിന്റെ ഘടന എങ്ങനെയാണെന്ന് മനസ്സിലാക്കണം
അണുമാതൃകകള്
Rutherford model
ആദ്യമായി അണുവിന്റെ ആന്തരിക ഘടനയെ കുറിച്ച് തൃപ്തികരമായ ഒരു വിശദീകരണം തന്നത് ന്യൂസിലാന്ഡില് നിന്നുള്ള ഒരു ഭൌതീകശാസ്ത്രജ്ഞനായ Ernest Rutherford ആണ് എന്ന് നമ്മള് സ്കൂളില് പഠിച്ചിട്ടുണ്ടല്ലോ. അണുമര്മ്മത്തിന്റെ (nucleus) ചുറ്റും ഭ്രമണം ചെയ്യുന്ന ഇലക്ട്രോണുകളുടെ ഒരു ഘടന ആയിരുന്നു Rutherford അണുവിനു വിവക്ഷിച്ചത്. അണുവിന്റെ ദ്രവ്യമാനത്തിന്റെ 99.98 % വും അണുമര്മ്മത്തില് ആണ് കേന്ദ്രീകരിച്ചിരിക്കുന്നത് എന്നും Rutherford സിദ്ധാന്തിച്ചു. ഇന്ന് നമ്മള്ക്ക് അണുമര്മ്മത്തില് പ്രോട്ടോണ്, ന്യൂട്രോണ് എന്നിങ്ങനെ കണികകള് ഉണ്ടെന്നും പ്രോട്ടോണിന് ധന ചാര്ജ്ജ് ആണെന്നും ഇലക്ട്രോണിന് ഋണ ചാര്ജ്ജ് ആണെന്നും ന്യൂട്രോണിന് ചാര്ജ്ജ് ഒന്നും ഇല്ല എന്നൊക്കെ അറിയാം.
Rutherford അണു മാതൃകയില് അണുവിന്റെ ഘടന വളരെ ലളിതമായിരുന്നു. ധന ചാര്ജ്ജുകള് മൊത്തം കേന്ദ്രീകരിച്ചിരിക്കുന്ന അണുമര്മ്മത്തിനു ചുറ്റും കറങ്ങുന്ന ഋണ ചാര്ജ്ജുള്ള ഇലക്ട്രോണുകള്.
Rutherfordന്റെ പരീക്ഷണങ്ങള്ക്ക് അണുവിന്റെ ആന്തരിക ഘടനയെ കുറിച്ച് വിശദീകരിക്കാന് കഴിഞ്ഞു എങ്കിലും എങ്ങനെയാണ് ഒരു അണു spectral line വികിരണം ചെയ്യുന്നത് എന്ന് വിശദീകരിക്കാന് കഴിഞ്ഞില്ല. മാത്രമല്ല ഋണ ചാര്ജ്ജുള്ള ഇലക്ട്രോണുകള് Rutherford അണു മാതൃകയില് പറയുന്നതു പോലെ കറങ്ങുകയാണെങ്കില് അത് വിദ്യുത് കാന്തിക തരംഗങ്ങള് പുറപ്പെടുവിക്കുകയും അവസാനം ഊര്ജ്ജനഷ്ടം സംഭവിച്ച് അണുമര്മ്മത്തില് വീഴും. പക്ഷെ അങ്ങനെയൊന്നും സംഭവിക്കുന്നില്ല.
ഏറ്റവും ലളിതമായ അണുഘടനയുള്ള ഹൈഡ്രജന് അണുവിന്റെ ദൃശ്യപ്രകാശ സ്പെക്ട്രത്തില് spectral lines 656.3 nm തുടങ്ങി 364.6 nm -ല് അവസാനിക്കുന്നു (1 nm = 10 -9 m). ഹൈഡ്രജന് അണുവിലെ ആദ്യത്തെ spectral lineനെ Hα എന്നും രണ്ടാമത്തേതിനെ Hβ എന്നും മൂന്നാമത്തേതിനെ Hγ എന്നിങ്ങനെ വിളിക്കുന്നു. 364.6nm എന്ന കുറഞ്ഞ തരംഗദൈര്ഘ്യത്തിലേക്ക് അടുക്കും തോറും കൂടുതല് വരകള് കാണാവുന്നതാണ്.
ബാമര് സീരീസ്
Image credit. The National Radio Astronomy Observatory (NRAO)
ഹൈഡ്രജന് സ്പെക്ട്രത്തിന്റെ ഈ ക്രമാനുഗതമായ പാറ്റേണ് ഗണിതപരമായി സ്വിസ് സ്ക്കൂള് അദ്ധ്യാപനായ Johann Balmer വിശദീകരിച്ചു. ഹൈഡ്രജന്റെ ദൃശ്യപ്രകാശത്തിലുള്ള spectral lineനെ ഇന്ന് Balmer lines എന്നും Hα മുതലുള്ള ക്രമാനുഗതമായ പാറ്റേണിനെ Balmer series എന്നും വിളിക്കുന്നു. നക്ഷത്രങ്ങളുടെ സ്പെക്ട്രത്തില് Balmer series ലുള്ള lines കാണപ്പെടുന്നു.
ചില കണക്കുകൂട്ടലുകളിലൂടെ Balmer lines ന്റെ തരംഗദൈര്ഘ്യം കണക്കാക്കുന്നതിനുള്ള ഒരു സമവാക്യം Johann Balmer കണക്കുകൂട്ടിയെടുത്തു. Balmerന്റെ സമവാക്യം താഴെ കാണുന്ന വിധത്തിലാണ് എഴുതുന്നത്.
ഈ സമവാക്യത്തില് n എന്നത് 2നു മുകളില് ഉള്ള ഒരു പൂര്ണ്ണസംഖ്യയാണ്. R എന്നത് Rydberg constant എന്ന് അറിയപ്പെടുന്നു. അതിന്റെ മൂല്യം 1.097 X 107 m-1 ആണ്.
മുകളില് പരിചയപ്പെടുത്തിയ സമവാക്യത്തില് n = 3 എന്ന് ഇട്ടാല് Hα യുടെ തരംഗദൈര്ഘ്യം കിട്ടുന്നു.Hβ കിട്ടാന് n = 4 എന്ന് കൊടുക്കുക. അങ്ങനെ ഓരോന്നും. അവസാനം n = ∞ എന്നു കൊടുത്താല് ഹൈഡ്രജന് സ്പെക്ട്രത്തിലെ അവസാനത്തെ spectral line-ന്റെ തരംഗ ദൈര്ഘ്യമായ 364.6 nm ഉം കിട്ടുന്നു.
പക്ഷെ ഈ പറഞ്ഞ spectral lines എങ്ങനെ ഉണ്ടാകുന്നു എന്നൊന്നും വിശദീകരിക്കാന് Rutherfordന്റെ അണു മാതൃകയ്ക്ക് കഴിഞ്ഞില്ല. അണുവിന് തൃപ്തികരമായ ഒരു ഘടനയും അതോടൊപ്പം spectral lines-ഉം വിശദീകരിക്കാനുള്ള ജോലി ഡാനിഷ് ഭൌതീകശാസ്ത്രജ്ഞനായ Neils Bohr ഏറ്റെടുത്തു.
Bohr Atom Model
അണുഘടനയും അണു സ്പെക്ട്രവും തമ്മിലുള്ള ബന്ധം പഠിക്കുവാന് തുനിഞ്ഞ Bohr തന്റെ പഠനം ഏറ്റവും ലളിതവും ദ്രവ്യമാനം കുറഞ്ഞതുമായ മൂലകവുമായ ഹൈഡ്രജന് അണുവിനെ പഠിക്കുന്നതില് നിന്ന് ആരംഭിച്ചു. അദ്ദേഹത്തിന്റെ അണുമാതൃകയെ ലളിതമായി താഴെ പറയുന്ന വിധത്തില് വിശദീകരിക്കാം.
- ഇലക്ട്രോണുകള് അണുമര്മ്മത്തിനു ചുറ്റും ഏതെങ്കിലും ഭ്രമണപഥത്തില് കൂടി സഞ്ചരിക്കില്ല; പിന്നെയോ ചില നിശ്ചിതങ്ങളായ പഥങ്ങളില് കൂടി മാത്രമേ സഞ്ചരിക്കൂ. ഓരോ പഥത്തിലുമുള്ള ഇലക്ട്രോണിന് നിശ്ചിതമായ ഊര്ജ്ജം ഉണ്ട്.
- മുകളില് പറഞ്ഞ പഥങ്ങളില് കൂടി സഞ്ചരിക്കുന്ന ഇലക്ടോണുകള് വിദ്യുത് കാന്തിക തരംഗങ്ങളെ പുറപ്പെടുവിക്കില്ല. ഈ പഥങ്ങളില് അവ stable ആയിരിക്കും. എന്നാല് ചിലപ്പോള് ഒരു പഥത്തില് നിന്ന് മറ്റൊരു തലത്തിലേക്ക് ഇലക്ട്രോണ് ചാടിയെന്നിരിക്കും. അങ്ങനെ ചാടുമ്പോള് ഈ രണ്ട് പഥങ്ങളുടെ ഊര്ജ്ജത്തിനു വ്യത്യാസത്തിനു തുല്യമായ ഒരു വിദ്യുത്കാന്തിക വികിരണത്തെ പുറത്തുവിടും. ഇതിന്റെ തരംഗദൈര്ഘ്യം നിശ്ചിതമാണ്.
ബോറിന്റെ ഘടനയില് ഉള്ള ഇലക്ടോണ് ഭ്രമണ പഥങ്ങളെ Bohr orbitals എന്നു പറയുന്നു. Bohr orbitals നെ n =1,2,3.... എന്നിങ്ങനെയാണ് അടയാളപ്പെടുത്തുന്നത്. ഈ orbitals-ല് കൂടി മാത്രമേ ഇലക്ടോണ് കണമര്മ്മത്തെ ചുറ്റി സഞ്ചരിക്കൂ. മുന്പ് പറഞ്ഞതു പോലെ ചിലപ്പോള് ഒരു പഥത്തില് നിന്ന് മറ്റൊരു പഥത്തിലേക്ക് ഇലക്ട്രോണ് ചാടിയെന്നിരിക്കും.
ഒരു ഇലക്ട്രോണിനു ഒരു Bohr orbit-ല് നിന്നു മറ്റൊരു Bohr orbit-ലേക്ക് ചാടണമെങ്കില് ഒരു പ്രത്യേക തരംഗദൈര്ഘ്യത്തിലുള്ള ഊര്ജ്ജം നേടുകയോ നഷ്ടപ്പെടുത്തുകയോ വേണം. ഒരു അക പഥത്തില് (inner orbit) നിന്ന് ഒരു പുറം പഥത്തിലേക്ക് (outer orbit) ചാടാന് ഇലക്ട്രോണ് ഊര്ജ്ജം നേടിയിരിക്കണം. അതേ പോലെ ഒരു പുറം പഥത്തില് നിന്ന് ഒരു അകം പഥത്തിലേക്ക് ചാടാന് ഇലക്ട്രോണ് ഊര്ജ്ജം നഷ്ടപ്പെടുത്തിയിരിക്കണം.
ഇലക്ട്രോണ് ഒരു പഥത്തില് നിന്ന് മറ്റൊരു പഥത്തിലേക്ക് ചാടുമ്പോള് അത് നേടുന്നതോ നഷ്ടപ്പെടുത്തുന്നതോ ആയ ഊര്ജ്ജം ഈ രണ്ട് പഥങ്ങളുടെ ഊര്ജ്ജത്തിന്റെ വ്യത്യാസത്തിനു തുല്യമായിരിക്കും. അതായത് ഒരു അക പഥത്തില് നിന്ന് ഒരു പുറം പഥത്തിലേക്ക് ചാടാന് ഇലക്ട്രോണിനു വേണ്ട അതേ ഊര്ജ്ജം തന്നെയായിരിക്കും പുറം പഥത്തില് നിന്നു അക പഥത്തിലേക്കു ചാടുമ്പോള് ഇലക്ട്രോണ് നഷ്ടപ്പെടുത്തുന്നതും.
ഈ പുറത്തുവിടുന്ന ഊര്ജ്ജം ക്വാണ്ടം പാക്കറ്റുകള് ആയിട്ടായിരിക്കും വികിരണം ചെയ്യുക എന്ന് ഐന്സ്റ്റീനും പ്ലാങ്കും സിദ്ധാന്തിച്ചു. ഈ ഊര്ജ്ജ പാക്കറ്റുകളുടെ ഊര്ജ്ജം E= hc/λ എന്ന സമവാക്യം കൊണ്ടാണ് സൂചിപ്പിക്കുന്നത്. ഇവിടെ h എന്നത് Planck's constant-ഉം, c എന്നത് പ്രകാശവേഗതയേയും λ എന്ന വികിരണത്തിന്റെ തരംഗദൈര്ഘ്യത്തേയും സൂചിപ്പിക്കുന്നു.
ചുരുക്കി പറഞ്ഞാല് ബോറിന്റെ ആറ്റം മോഡലിനു ഒരു മൂലകത്തിന്റെ അണു ഒരേ തരംഗദൈര്ഘ്യത്തിലുള്ള വികിരണം ആണ് പുറത്തുവിടുകയും ആഗിരണം ചെയ്യുന്നത് എന്ന കിര്ക്കോഫിന്റെ നിരീക്ഷണത്തെ വിശദീകരിക്കാന് പറ്റി.
ബോറിന്റെ അണു മാതൃക എങ്ങനെയാണ് emission line spectrum ഉണ്ടാകുന്നത് എന്നും മനസ്സിലാക്കാന് നമ്മെ സഹായിച്ചു. ഒരു വാതകം ചൂടു പിടിക്കുമ്പോള് അതിലെ അണുക്കള് അന്യോന്യം അങ്ങോട്ടും ഇങ്ങോട്ടും വേഗത്തില് സഞ്ചരിച്ച് തമ്മില് കൂട്ടിയിടിക്കുന്നു. ഈ കൂട്ടിയിടി ആ അണുക്കളിലെ ഇലക്ട്രോണുകളെ ഉദ്ദീപിച്ച് ഉയര്ന്ന ഊര്ജ്ജനിലകളിലേക്ക് തള്ളി വിടുന്നു. ഈ ഉയര്ന്ന നിലകളില് നിന്നു ഇലക്ട്രോണ് പിന്നീട് അതിന്റെ സാധാരണ നിലകളിലേക്ക് മടങ്ങി വരുന്നു. മറങ്ങി വരുമ്പോള് രണ്ട് ഊര്ജ്ജനിലകളുടേയും ഊര്ജ്ജത്തിന്റെ വ്യത്യാസത്തിനു തുല്യമായ ഫോട്ടോണുകള് ഉല്ത്സജനം ചെയ്യുന്നു. അങ്ങനെ ചൂടുള്ള ഒരു വാതകം emission line spectrum ഉണ്ടാക്കുന്നു.
ഇനി absorption line spectrum ഉണ്ടാകുന്നത് എങ്ങനെയാണെന്ന് നോക്കാം. തണുത്ത ഒരു വാതകത്തിലെ അണുക്കളിലെ ഇലക്ട്രോണുകള് താഴ്ന്ന നിലകളില് ആയിരിക്കും. ഈ തണുത്ത വാതകത്തിലേക്ക് സമീപത്തുള്ള ചൂടുള്ള continuous spectrum ഉണ്ടാക്കുന്ന ഒരു വസ്തുവില് നിന്നുള്ള രശ്മികള് കടന്നു പോകുന്നു എന്നു കരുതുക. മിക്കവാറും രശ്മികള് ഒരു സ്വാധീനവും ചെലുത്താതെ കടന്നു പോകും. പക്ഷെ ഈ വാതകത്തിലെ ഊര്ജ്ജനിലകളുടെ വ്യത്യാസത്തിനു തുല്യമായ ഊര്ജ്ജം ഉള്ള ഫോട്ടോണുകളെ മാത്രം ആഗിരണം ചെയ്ത് വാതകത്തിലെ ഇലക്ട്രോണുകള് ഉയര്ന്ന നിലകളിലേക്ക് പോകും. ചുരുക്കി പറഞ്ഞാല് ചില പ്രത്യേക ഫോട്ടോണുകളെ മാത്രം വാതകം ആഗിരണം ചെയ്യും. വാതകത്തിന്റെ സ്പെക്ട്രം പരിശോധിക്കുന്ന ഒരാള്ക്ക് അങ്ങനെ absorption line spectrum ലഭിയ്ക്കും.
തന്റെ അണുമാതൃകയിലെ അനുവനദീയമായ പ്രത്യേക ഭ്രമണ പഥങ്ങള് എന്ന ചിത്രവും E = hc/λ എന്ന സമവാക്യവും ഉപയോഗിച്ച് ബോറിന് ഗണിതശാസ്ത്രപരമായി ഒരു ഇലക്ട്രോണ് N എന്ന അക ഭ്രമണ പഥത്തില് നിന്ന് nഎന്ന പുറം ഭ്രമണ പഥത്തിലേക്ക് ചാടുമ്പോള് പുറപ്പെടുവിക്കുന്ന ഫോട്ടോണിന്റെ തരംഗദൈര്ഘ്യം കണക്കാക്കാന് പറ്റി. ആ സമവാക്യം താഴെ കൊടുക്കുന്നു.
ഇവിടെ N എന്നത് അക ഭ്രമണ പഥത്തിന്റെ സംഖ്യ n എന്നത് പുറം ഭ്രമണ പഥത്തിന്റെ സംഖ്യ R= Rydberg constant, λ എന്നത് വികിരണം ചെയ്യുകയോ ആഗിരണം ചെയ്യുകയോ ചെയ്ത ഫോട്ടോണിന്റെ തരംഗദൈര്ഘ്യം.
ഇനി ഈ സമവാക്യത്തില് N = 2 എന്ന് കൊടുത്താല് Balmerന്റെ സമവാക്യം ലഭിയ്ക്കുന്നു. അതിനാല് ഇലക്ട്രോണ് N = 2 എന്ന അക ഭ്രമണ പഥത്തില് നിന്നു പഥത്തില് നിന്ന് n = 3,4,5...എന്നിങ്ങനെയുള്ള പുറം ഭ്രമണ പഥത്തിലേക്ക് ചാടുമ്പോഴാണ് Balmer series-ലിലുള്ള spectral lines ഉണ്ടാകുന്നത് എന്ന് Bohr സിദ്ധാന്തിച്ചു. മാത്രമല്ല Bohrന്റെ ഈ സമവാക്യം ദൃശ്യപ്രകാശം അല്ലാത്ത മറ്റ് തരംഗദൈര്ഘ്യങ്ങളില് നിന്ന് പുറത്തുവരുന്ന spectral lines നേയും വിശദീകരിക്കുന്നു.
Bohrന്റെ ഈ സമവാക്യത്തില് N = 1എന്നും n = 2,3,4,5... എന്നും കൊടുത്താല് പുതിയൊരു spectral lines ന്റെ പുതിയൊരു സീരീസ് കിട്ടുന്നു. ഇതിനു Lyman series എന്നാണ് പേര്. ഈ സീരീസിലുള്ള spectral lines, Lα (തരംഗദൈര്ഘ്യം 122 nm) തുടങ്ങി L∞ (തരംഗദൈര്ഘ്യം 91 nm) യില് അവസാനിക്കുന്നു. ഈ spectral lines എല്ലാം വിദ്യുത്കാന്തികവര്ണ്ണരാജിയില് അള്ട്രാവയലറ്റ് ഭാഗത്താണ് വരിക.
ഇതേ പോലെ Bohrന്റെ ഈ സമവാക്യത്തില് N = 3 എന്നും n = 4,5,6,... എന്നും കൊടുത്താല് Paschen series എന്ന വേറൊരു spectral line സീരീസ് കിട്ടുന്നു. ഈ സീരീസിലുള്ള spectral lines, Pα (തരംഗദൈര്ഘ്യം 1875 nm) തുടങ്ങി P∞ (തരംഗദൈര്ഘ്യം 821 nm) യില് അവസാനിക്കുന്നു. ഈ spectral lines മൊത്തം വിദ്യുത്കാന്തിക വര്ണ്ണരാജിയില് ഇന്ഫ്രാറെഡ് ഭാഗത്താണ് വരിക.
Lyman seriesലെ ഏറ്റവും കുറഞ്ഞ തരംഗദൈര്ഘ്യമായ L∞ (തരംഗദൈര്ഘ്യം 91 nm) ഒരു പ്രത്യേകത ഉണ്ട്. ഏറ്റവും അകത്തുള്ള പഥമായ N = 1 ല് നിന്ന് ഒരു ഇലക്ട്രോണ് 91 nm തരംഗദൈര്ഘ്യത്തിലുള്ള ഒരു ഫോട്ടോണ് ആഗിരണം ചെയ്താല് അത് n = ∞ എന്ന ഭ്രമണപഥത്തിലേക്ക് മാറ്റപ്പെടുന്നു. പക്ഷെ ഈ ഭ്രമണപഥം കണമര്മ്മത്തില് നിന്നു വളരെയധികം അകലെയാണ്. അതിനാല് ഇലക്ട്രോണ് അണുവില് നിന്ന് പുറത്തു ചാടി എന്നു പറയാം. ഇങ്ങനെ ഇലക്ട്രോണ് അണുവില് നീന്ന് നീക്കപ്പെടുന്ന പ്രക്രിയക്കാണ് ionization എന്നു പറയുന്നത്. ചുരുക്കി പറഞ്ഞാല് ഹൈഡ്രജന് അണു അള്ട്രാവയലറ്റ് തരംഗദൈര്ഘ്യത്തിലുള്ള ഒരു 91nm ഫോട്ടോണ് ആഗിരണം ചെയ്താല് അത് അയണീകൃതമാകുന്നു.
മുകളില് പറഞ്ഞതെല്ലാം സംക്ഷിപ്തമായി ചിത്രീകരിച്ചിരിക്കുന്ന ഒരു ഡയഗ്രം നോക്കൂ.
Hyodrogen spectral series
Image credit. The National Radio Astronomy Observatory (NRAO)
Qunatum model
അണുവിനെ കുറിച്ച് നമുക്ക് ഇന്നുള്ള അടിസ്ഥാന വിവരത്തിന് നമ്മള് അണുവിന്റെ ബോര് മാതൃകയോട് കടപ്പെട്ടിരിക്കുന്നു. പക്ഷെ അണുവിന്റെ ആധുനിക മാതൃക ക്വാണ്ടം മെക്കാനിക്സ് അടിസ്ഥാനമാക്കിയുള്ളതാണ്. ഇതില് ഭൌതീക ശാസ്ത്രജ്ഞന്മാര് ഇലക്ട്രോണ് ഒരു അണുവില് പ്രത്യേക ഭ്രമണ പഥത്തിലൂടെ സഞ്ചരിക്കുന്നു എന്ന് സിദ്ധാന്തിക്കുന്നില്ല. പകരം ഇലക്ട്രോണ് അണുവില് ചില പ്രത്യേക ഊര്ജ്ജനിലകള് സ്വായത്തമാക്കുന്നു എന്നാണ് സിദ്ധാന്തിക്കുന്നത്. ഇതിന്റെ ഇടയ്ക്കുള്ള മറ്റ് ഊര്ജ്ജനിലകള് കൈവരിക്കാന് ഇലക്ട്രോണുകള്ക്ക് ആവില്ല. ഈ ഊര്ജ്ജനിലകളെ ക്വാണ്ടം നിലകള് എന്നു പറയുന്നു.
ക്വാണ്ടം മെക്കാനിക്സില് ഇലക്ട്രോണിനെ ഒരു കണികയായിട്ടല്ല മറിച്ച് കണികയുടേയും തരംഗത്തിന്റേയും സ്വഭാവം ഒരുമിച്ച് പ്രദര്ശിപ്പിക്കുന്ന ഒന്നായിട്ടാണ് കരുതുന്നത് (ഇതില് കൂടുതല് ഇതിനെ കുറിച്ച് ഇപ്പോള് പറയുന്നില്ല. ഇതിനെ കുറിച്ച് ചില ചര്ച്ചകള് ഡാലിയുടെ അദ്വൈതവും പദാര്ത്ഥത്തിന്റെ ദ്വന്ദ്വ സ്വഭാവവും എന്ന പോസ്റ്റില് നടന്നിട്ടുണ്ട്. താല്പര്യമുള്ളവര്ക്ക് അത് വായിക്കാം).
Quantum model-ല് ഒരു അണുവിന്റെ ഘടന കാണിക്കുന്നതിനുള്ള ഒരു പ്രധാന ഉപാധി ആണ് അതിന്റെ energy level diagram കാണിക്കുക എന്നത്. ഉദാഹരണത്തിനു താഴെയുള്ള ചിത്രത്തില് കൊടുത്തിരിക്കുന്ന ഹൈഡ്രജന്റെ energy level diagram നോക്കൂ.
ഏറ്റവും താഴ്ന്ന ഊര്ജ്ജ നില ground state എന്ന് അറിയപ്പെടുന്നു. ഇത് ബോര് അണുമാതൃകയിലെ n = 1 എന്ന പഥത്തിനു തുല്യമാണ്. അതിനു മുകളില് ഉള്ള ഊര്ജ്ജനിലകള് excited states എന്ന് അറിയപ്പെടുന്നു. ഇത് ബോര് അണുമാതൃകയിലെ n =1നു മുകളില് ഉള്ള ഭ്രമണ പഥങ്ങള് ആണ്.
ഒരു ഇലക്ട്രോണിന് ground state ല് (n = 1) നിന്ന് excited states ആയ n = 2 ലേക്ക് ചാടണമെങ്കില് അതിന് 122 nm തരംഗദൈര്ഘ്യം ഒരു ഫോട്ടോണ് (Lyman photon എന്ന് ഇതിനെ പറയാറുണ്ട്) ആഗിരണം ചെയ്യും. അതിനു മുകളിലോ താഴെയോ തരംഗദൈര്ഘ്യം ഉള്ള ഫോട്ടോണ് ആണെങ്കില് ഈ ചാട്ടം സംഭവിക്കില്ല. ഫോട്ടോണിന്റെ ഊര്ജ്ജം കണക്കാക്കുന്നതിനുള്ള സമവാക്യം E = hν = hc/λ. അതിന്റെ SI unit J (Joule) ആണെങ്കിലും സാധാരണ ഇത് eV (electron volt) എന്ന ഏകകത്തിലാണ് പറയുക ഭൌതീകശാസ്ത്രജ്ഞന്മാര് പറയുക.
1 eV= 1.6 X 10-19 J.
Lyman photonന്റെ ഊര്ജ്ജം 10.19 eV ആണ്. അതിനാല് ബോര് മാതൃകയിലെ n = 2 ഭ്രമണപഥത്തെ 10.19 eV എന്ന ഊര്ജ്ജനില കൊണ്ട് സൂചിപ്പിക്കുന്നു. അതേ പോലെ n = 3 നെ 12.07 eV എന്നിങ്ങനെ ഒരോന്നും. n = ∞ എന്ന ഭ്രമണപഥത്തിന്റെ ഊര്ജ്ജനില 13.6 eV. അതിന്റെ അര്ത്ഥം 13.6 eV ഓ അതിനു മുകളിലോ ഉള്ള ഊര്ജ്ജം ഉള്ള ഒരു ഫോട്ടോണ് ഒരു ആഗിരണം ചെയ്യുകയാണെങ്കില് ആ ഇലക്ട്രോണ് അണുവില് നിന്ന് വേര്പെടും മറ്റൊരു വിധത്തില് പറഞ്ഞാല് ആണു അയണീകൃതമാകും.മുകളില് കാണിച്ചിരിക്കുന്ന ഊര്ജ്ജനിലകള് ഏതെങ്കിലും രണ്ടെണ്ണം തമ്മിലുള്ള ഊര്ജ്ജ വ്യത്യാസം കണക്കാക്കിയാല് ആ ഊര്ജ്ജനിലയിലേക്ക് ചാടാന് വേണ്ട ഫോട്ടോണിന്റെ ഊര്ജ്ജം ലഭിയ്ക്കും.
ഈ പറഞ്ഞത് വിശദീകരിക്കുന്ന ഒരു ചിത്രം നോക്കൂ.
Quantum model of spectral lines
Image credit. The National Radio Astronomy Observatory (NRAO)
ഉയര്ന്ന മൂലകങ്ങളുടെ energy-level diagram പിന്നേയും സങ്കീര്ണ്ണമാണ്. അതിനെ കുറിച്ച് വിശദീകരിക്കണം എങ്കില് ആദ്യം പ്രീഡിഗ്രിക്ക് ഒക്കെ കെമിസ്ട്രിയിലും ഫിസിക്സിലും പഠിച്ച ആറ്റോമിക് എനര്ജി ലെവലസ് ആദ്യം വിശദീകരിക്കേണ്ടി വരും. അതിനൊന്നും ഇവിടെ മുതിരുന്നില്ല. സോഡിയത്തിന്റെ വര്ണ്ണരാജിയില് ദൃശ്യ പ്രകാശ പരിധിയില് വരുന്ന ഏറ്റവും പ്രധാനപ്പെട്ട രണ്ട് spectral lines ആണ് Sodium D lines. അതിന്റെ തരംഗദൈര്ഘ്യം 588.99 nm ഉം 588.59 nmഉം ആണ്.
ജ്യോതിശാസ്തജ്ഞന്മാര് energy level diagram നക്ഷത്രങ്ങളുടെ സ്പെക്ട്രം പഠിക്കുമ്പോള് ഉപയോഗിക്കുന്നു. ഉദാഹരണത്തിന് മുകളില് പരിചയപ്പെടുത്തിയ Sodium D lines ഒരു നക്ഷത്രസ്പെക്ട്രത്തില് ഉണ്ടെങ്കില് ആ നക്ഷത്രത്തില് Sodium ഉണ്ടന്നാണ് അര്ഥം. അതിനര്ഥം ആ നക്ഷത്രം ഒരു Population I നക്ഷത്രം ആണെന്നാണ്. സൂര്യന് ഒരു Population I നക്ഷത്രമാണ്. Population I നക്ഷത്രം എന്താണെന്നൊക്കെ വഴിയെ പരിചയപ്പെടാം.
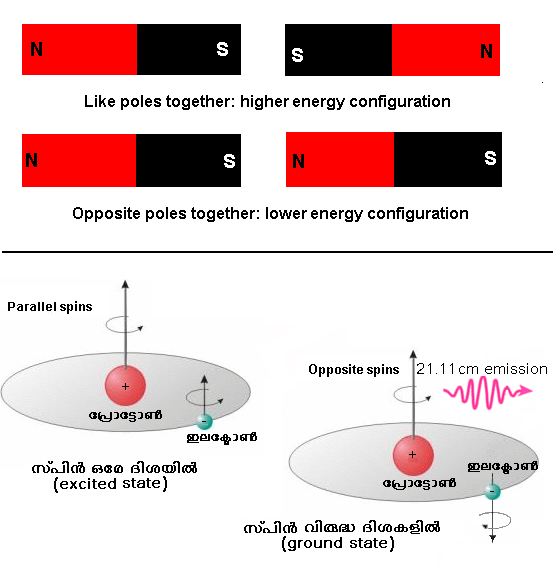
21cm spectral line emission of neutral hydrogen
ഇത് വേറൊരു പ്രധാനപ്പെട്ട spectral line emission ആണ്. ഇത് എന്താണെന്നും ജ്യോതിശാസ്ത്രത്തില് ഇതിനുള്ള പ്രാധാന്യം എന്താണെന്നും നോക്കാം. ഇലക്ട്രോണ് പ്രോട്ടോണ് മുതലായ കണികകള്ക്ക് ദ്രവ്യമാനവും ചാര്ജ്ജും ഉണ്ടെന്ന് നിങ്ങള് പഠിച്ചിട്ടുണ്ടല്ലോ. പക്ഷെ ഇതിനു പുറമേ വേറെ ഒരു പ്രധാന ഗുണം കൂടി ഈ കണങ്ങള്ക്ക് ഉണ്ട്. അതാണ് angular momentum commonly called as spin. ഇത് എന്താണെന്ന് നോക്കാം. നമുക്ക് ഇലക്ട്രോണിനേയും പ്രോട്ടോണിനേയും കറങ്ങുന്ന ചെറിയ കാന്തങ്ങളോട് ഉപമിക്കാം. ഈ രണ്ട് കാന്തങ്ങളുടേയും സമധ്രുവങ്ങള് ഒരേ ദിശയില് ആകുമ്പോള് ആ സിസ്റ്റത്തിന്റെ ഊര്ജ്ജം കൂടുതലായിരിക്കും. എന്നാല് ധ്രുവങ്ങള് വ്യത്യസ്തദിശയില് ആകുമ്പോള് ആ സിസ്റ്റത്തിന്റെ ഊര്ജ്ജം കുറവായിരിക്കും. ചിത്രം നോക്കൂ.
21 cm spectral line emission of neutral hydrogen Image credit
The National Radio Astronomy Observatory (NRAO)
പക്ഷെ ഏതൊരു സിസ്റ്റത്തിന്റേയും അടിസ്ഥാന ത്വര ഏറ്റവും താഴ്ന്ന നിലയില് ഇരിക്കുക എന്നതാണ്. ഇനി മുകളില് പറഞ്ഞ spin എന്ന ഗുണം കാരണം ഇലക്ട്രോണും പ്രോട്ടോണും ചെറിയ കാന്തങ്ങളായി വര്ത്തിക്കും. ഇലക്ട്രോണും പ്രോട്ടോണും ഒരേ ദിശയില് spin ചെയ്യുമ്പോള് ആ സിസ്റ്റത്തിന്റെ ഊര്ജ്ജം എതിര് ദിശയില് spin ചെയ്യുമ്പോള് ഉള്ള ഊര്ജ്ജത്തേക്കാള് കൂടുതല് ആയിരിക്കും. ഇലക്ട്രോണ് ഉയര്ന്ന നിലയിലേക്ക് പോകുന്നത് അതിനു വേണ്ട ഊര്ജ്ജത്തിന്റെ ഒരു ഫോട്ടോണ് ആഗിരണം ചെയ്യുമ്പോഴോ അല്ലെങ്കില് അണുക്കള് തമ്മില് കൂട്ടിയിടിക്കുമ്പോഴോ ആണ്. ഇലക്ട്രോണ് അതിന്റെ spinന്റെ ദിശ മാറ്റുമ്പോള് (അതായത് ഉയര്ന്നതില് നിന്ന് താഴ്ന്നതിലേക്ക്) രണ്ട് ഊര്ജ്ജനിലകളുടേയും വ്യത്യാസത്തിനു തുല്യമായ ഒരു ഫോട്ടോണ് പുറത്തുവിടും. ഈ പ്രക്രിയക്ക് spin-flip transition എന്നാണ് പറയുന്നത്. (വൈദ്യശാസ്ത്രത്തില് ഉപയോഗിക്കുന്ന Magnetic Resonance Imaging (MRI)- ല് പുറകില് ഉള്ള ശാസ്ത്രവും Spin-Flip transition ആണ്)
ഇനി ഇങ്ങനെ പുറത്തുവിടുന്ന ഫോട്ടോണിന്റെ ഊര്ജ്ജം വളരെ കുറവായിരിക്കുന്നത് കൊണ്ട് അതിന്റെ ആവൃത്തിയും വളരെ കുറവായിരിക്കും. മറ്റൊരു വിധത്തില് പറഞ്ഞാല് തരംഗദൈര്ഘ്യം കൂടുതല് ആയിരിക്കും. ഈ spin-flip transition ന്റെ തരംഗദൈര്ഘ്യം 21 cm ആയിരിക്കും (കൃത്യമായി ഇതു 21.11 cm ആണ്. സൌകര്യത്തിനുവേണ്ടി 21 cm എന്നു പറയുന്നു). അത് വിദ്യുത് കാന്തികവര്ണ്ണരാജിയില് റേഡിയോ മേഖലയില് വരുന്ന തരംഗമാണ്. ഇതിനെയാണ് 21cm spectral line emission of neutral hydrogen എന്നു പറയുന്നത്. നമ്മുടെ ഗാലക്സിയുടെ നമുക്ക് എതിരായി ഉള്ള ഭാഗം ഗാലക്സിയുടെ കേന്ദ്രഭാഗത്ത് നക്ഷത്രാന്തരീയ മാധ്യമത്തിന്റെ സാന്ദ്രത കൂടിയതു കാരണം ദൃശ്യപ്രകാശത്തില് വീക്ഷിക്കാന് പറ്റില്ല. കാരണം അവിടെ നിന്ന് പുറപ്പെടുന്ന തരംഗദൈര്ഘ്യം കൂടിയ എല്ലാ തരംഗങ്ങളേയും നക്ഷത്രാന്തരീയ മാധ്യമം ആഗിരണം ചെയ്യും. പക്ഷെ ഈ നക്ഷത്രാന്തരീയ മാധ്യമത്തെ കടന്ന് പുറത്തുവരാന് ആവൃത്തികുറഞ്ഞ റേഡിയോ തരംഗങ്ങള്ക്ക് ആകും. അങ്ങനെ പുറത്തു വരുന്ന റേഡിയോ തരംഗത്തില് ഏറ്റവും പ്രധാനപ്പെട്ടതാണ് 21cm spectral line emission. നമ്മുടെ ഗാലക്സിയുടെ spiral രൂപത്തെ കുറിച്ച് ഒക്കെ മനസ്സിലാക്കാന് സഹായിച്ചത് ഈ തരംഗമാണ് സഹായിച്ചത്. പ്രപഞ്ചത്തിന്റെ തണുത്ത പലമേഖലകളെ കുറിച്ച് പഠിക്കാനും ഈ തരംഗമാണ് നമുക്ക് പ്രയോജനപ്പെടുന്നത്.
ഇതു വരെ പരിചയപ്പെടുത്തിയതു കൂടാതെ മറ്റു പല തരത്തിലും വിദ്യുത്കാന്തിക തരംഗങ്ങള് നിര്മ്മിക്കപ്പെടുന്നു. ഉദാഹരണത്തിനു Synchrotron radiation, Masers, Compton scattering അങ്ങനെ പലതും. ഇതു വരെയുള്ള പോസ്റ്റുകളില് നിന്നു നേടിയ അറിവ് വച്ച് പരിചയപ്പെടുത്താവുന്നത് മാത്രമേ ഇവിടെ കൈകാര്യം ചെയ്തിട്ടുള്ളൂ. മാത്രമല്ല അണുമര്മ്മത്തിലെ കണികകളുടെ പ്രവര്ത്തനം മൂലം ഉണ്ടാകുന്ന വിദ്യുത്കാന്തിക തരംഗങ്ങളെ ഇവിടെ പ്രതിപാദിച്ചിട്ടില്ല. അതൊക്കെ കുറച്ചു സങ്കീര്ണ്ണം ആണ്. അതിനാല് ഭാവിയില് എപ്പോഴെങ്കിലും സന്ദര്ഭം ഒത്തു വരികയാണെങ്കില് ലേഖനത്തിനു ആവശ്യമുള്ളവയെ അപ്പപ്പോള് പരിചയപ്പെടുത്താം.
ഇനി ഇതില് കൂടുതല് ഈ വിഷയം വിശദീകരിക്കുന്നില്ല. ഈ പോസ്റ്റില് നമ്മള് Spectroscopyയുടേയും Atomic Physicsന്റേയും ചില അടിസ്ഥാനപാഠങ്ങള് ആണ് മനസ്സിലാക്കിയത്. പക്ഷെ അതിലൂടെ spectral linesനെ നിങ്ങള്ക്ക് പരിചയപ്പെടുത്താന് പറ്റി. ഞാന് spectral lines ഒക്കെ നിങ്ങള്ക്ക് എങ്ങനെ പരിചയപ്പെടുത്തും എന്ന് ശങ്കിച്ചിരിക്കുകയായിരുന്നു. സുനില് ചേട്ടന്റെ ചോദ്യം അതിനുള്ള ഒരു വഴി കാണിച്ചുതന്നു. Spectroscopy അതില് തന്നെ വലിയൊരു ശാസ്ത്ര ശാഖയാണ്. ഇനി ഈ വിഷയത്തില് കൂടുതല് അറിവ് വേണമെന്നുള്ളവര് ബിരുദ, ബിരുദാനന്തര നിലവാരത്തിലുള്ള Spectroscopyയുടേയും Atomic Physics-ന്റേയും പുസ്തകങ്ങള് വായിച്ച് മനസ്സിലാക്കുക. പക്ഷെ കൂടുതല് ആഴത്തിലേക്ക് പോകണമെങ്കില് ഗണിതത്തിലും അത്യാവശ്യം ജ്ഞാനം വേണം. പക്ഷെ Spectroscopy വളരെ രസകരമായ ഒരു ശാസ്ത്രശാഖയാണ്. നമ്മുടെ സ്വന്തം C. V. Raman -ന് നോബേല് സമ്മാനം കിട്ടിയത് ഈ മേഖലയിലെ പഠനത്തിനാണ്. ഇന്ഡ്യയിലെ ശാസ്ത്രസമൂഹം (പ്രത്യേകിച്ച് IISc-യും Raman Research Institute (RRI)-ഉം) ഈ ശാസ്ത്രശാഖയ്ക്ക് കാര്യമായ സംഭാവന നല്കിയിട്ടുണ്ട്.
ആധാര പ്രമാണങ്ങള്
- Riches of the Rainbow, Schaff F, Sky &Telescope; August 1992
- Unlocking the chemical secrets of the cosmos, Gingerich, Sky & Telescope; July 1981
- Universe, Kaufmann and Freedman, W H Freeman and Company, New York
- പ്രപഞ്ച രേഖ, പി. പരമേശ്വരന്, ശാസ്ത്ര സാഹിത്യ പരിഷത്ത് പ്രസിദ്ധീകരണം
- NASA website